3. Materiaal en methoden
3.1. Het verzamelen en kweken
Xenylla humicola was ter beschikking, afkomstig uit kokoskompost (ASEF kokospotgrond, verrijkt met organische meststoffen). Met behulp van een aspirator (Figuur 14) werden de diertjes, per +/- honderd, overgezet in kleine, plastieken, ronde potjes (diameter = 5cm, hoogte = 2,5cm) met een waterverzadigde gips-norietbodem (9/10 gips en 1/10 koolstof).

Figuur 14: een aspirator
Door een mijteninvasie tijdens de examens van eerste semester, zijn de springstaarten verloren gegaan, een zoektocht naar nieuwe collembola is begonnen.
Extractie van een paar graszoden en strooisel leveren niets op, uiteindelijk worden toch Brachystomella parvula en Ceratophysella gibbosa gevonden in de plantentuin van de Universiteit Gent aan de K. L. Ledeganckstraat. Die worden ingezameld met behulp van een kruimeldief (Black & Decker, Classic Dustbuster). Het verzamelde materiaal wordt ter plaatse overgebracht in een plastic container (breedte = 12cm, lengte = 18cm, hoogte = 12cm) met een gipsbodem. Brachystomella parvula, en in mindere mate Ceratophysella gibbosa, wordt gevonden in het gras bij de grote vijver, vochtig weer (geen regen!) zorgt voor een goede vangst, daar de springstaarten zich aan de oppervlakte bevinden. Bij droog weer trekken de Collembola zich terug in de bodemcapillairen.
In het labo worden de hierboven vermelde soorten door middel van een aspirator van het overige, opgezogen materiaal gescheiden. Door de geringe grote van de springstaarten maken we hierbij gebruik van binoculaire loep (WILD M3, vergroting 10x16x en 10x40x). De springstaarten worden overgeplaatst naar een potje met schroefdop (diameter = 3.5cm, hoogte
= 7cm) met een waterverzadigde gips-norietbodem. Een goede afsluiting is zeker nodig, wegens de grote ontsnappingsdrang van de diertjes.
De culturen van springstaarten worden regelmatig (bijna dagelijks) gecontroleerd op mijten, maar ook andere predatoren (bij name kakkerlakken,…) werden al aangetroffen in de culturen. Schimmel wordt telkens verwijderd. Als voedsel wordt gedroogde bakkersgist (Torula utilis) gebruikt, later werd dit vervangen door stukjes champignon, waardoor minder schimmel aangetroffen wordt.
3.2. Gebruikte soorten
De familie van de Brachystomellidae, met een 96 soorten, werd beschouwd als een subfamilie van de Neanuridae, maar is nu door de meeste auteurs erkend als voldoende verschillend voor een familie status. Het meest karakteristiek kenmerk is de volledige afwezigheid van de mandibels (Adams and Salmon, 1972). De familie is wereldwijd verspreid en omvat de algemene en wijd verspreidde Brachystomella parvula.
Brachistomellids zijn meestal beperkt tot een vochtige bodem, toch worden sommige genera en soorten geassocieerd met fungale vruchtlichamen (Greenslade, 1994a).
De collembolen van de familie Hypogastruridae, met 580 vertegenwoordigers, worden gekenmerkt door een mandibulaire plaat op de mandibula, de maxillen hebben een krachtig cardo tussen stipes en fulcrum.
Hypogastrurinae, de grootste subfamilie met 577 soorten, zijn te vinden in talrijke habitats; zoals de bodem, onder schors, de kust, commerciële championnenbedden en filters van rioolwater, waar ze extreem abundant kunnen voorkomen. Springstaarten van deze subfamilie worden het vaakst in reusachtige ‘zwermen’ gevonden.
De Isotomidae zijn waarschijnlijk een vroege aftakking van de evolutie leidend naar de ‘hogere’ Entomobryomorpha. De abdominale segmenten zijn allen van gelijk lengte. De meeste soorten van deze familie leven in de bodem, in spleten aan de zeekust of zijn gelinkt aan zoetwater. Isotomidae worden over gans de wereld aangetroffen, sommigen in extreme habitats zoals woestijnen (Suhardjono & Greenslade, 1994), anderen werden gevonden op Antarctica.
Parthenogenetische Folsomia candida worden alom gebruikt door ecotoxicologen in een standaard test om de effecten van chemicaliën op non-target bodem invertebraten in te schatten.
3. Arena’s
Er zijn maar twee verschillende arena’s gebruikt, die enkel verschillen in grootte.
In een klein kuipje wordt voorzichtig een dun laagje gips-noriet, gemaakt in een plastieken bak, gegoten. Het voorzichtig gieten is belangrijk, zodat er zo weinig mogelijk luchtbellen in de gips-norietbodem zitten. Daar de springstaarten vrij klein zijn, kruipen ze in de gaatjes, waardoor de resultaten moeilijk te analyseren zijn.
Na 24h worden de arena’s bevochtigd met gewoon kraantjeswater, waarna ze klaar zijn voor gebruik. De arena’s worden bedekt met een transparant, vierkant raster (Figuur 15), waarin enkele gaatjes tegen al te veel condens.
|
A1 |
B |
C |
D |
|
2 |
|||
|
3 |
|||
|
4 |
Figuur 16: Transparant, vierkant raster om tijdens de experimenten de positie van de springstaarten te kunnen vastleggen; 16 sectoren van a1 tot d4 ( zijde = 4cm)
De grotere arena’s worden vervaardigd uit vier draagglaasjes (26mmx76mm), die met behulp van kleefband aan elkaar worden bevestigd. In een plastieken kuip wordt de gips-noriet aangemaakt en dan overgegoten in een PVC-container, waarna de arena’s erin geplaatst worden. Ook hier is het belangrijk luchtbellen te vermijden. Na 24h drogen worden de arena’s gescheiden en op de helft van een grote petrischaal (diameter = 135mm) geplaatst. Na toevoegen van kraantjeswater, om de arena’s voldoende vochtig te maken, worden ze overdekt door een transparant, vierkant plastieken raster (Figuur 16).
|
a |
b |
c |
d |
e |
f |
g |
h |
i |
j |
|
|
1 |
||||||||||
|
2 |
||||||||||
|
3 |
||||||||||
|
4 |
||||||||||
|
5 |
||||||||||
|
6 |
||||||||||
|
7 |
||||||||||
|
8 |
||||||||||
|
9 |
||||||||||
|
10 |
Figuur 16: Transparant, vierkant, plastieken raster om tijdens de experimenten de positie van de springstaarten te kunnen vastleggen; 100 sectoren van a1 tot j10 (zijde = 7,5mm).
3.4. Experimenten
Alle experimenten werden in het laboratorium uitgevoerd bij kamertemperatuur (22°C + 2°C) en -vochtigheid, afgeschermd van het zonlicht. Op zeer zonnige en warme dagen kan de temperatuur oplopen tot 25°C en meer.
Omwille van de geringe grootte van de collembolen werd er bij elk experiment gebruik gemaakt van een binoculaire loep (WILD M3, vergroting 10x16x en 10x40x) en een koude lichtbron (VOLPI AG, ultralux 500-H).
Xenylla humicola:
Zestien individuen worden in een klein, vierkant gips-norietarena geplaatst met behulp van een aspirator. Eens de springstaarten in de arena, wordt om de vijf minuten hun positie genoteerd op voorgedrukte bladeren met rasters. Dit gebeurde over een periode van drie uur.
Dit experiment werd tweemaal uitgevoerd, waarvan één niet betrouwbaar wegens teveel gaatjes in de gips-norietbodem.
Brachystomella parvula:
Wederom worden zestien springstaarten in een klein gips-norietarena geplaatst door middel van een aspirator. Om de vijf minuten wordt gedurende twee uur de positie van de collembolen genoteerd op voorgedrukte bladeren met rasters. Tweemaal werd het experiment op deze manier uitgevoerd. Ditzelfde experiment werd ook éénmaal gedaan met een veertigtal Brachystomella’s in een klein gips-norietarena. Ook over een periode van twee uur om de vijf minuten.
Vijfentwintig springstaarten worden in een grote, vierkante gips-norietarena geplaatst met een aspirator. Na tien minuten worden de collembolen om de tien minuten gecontroleerd op hun positie, welke genoteerd wordt op voorgedrukte papieren met rasters. Dit experiment duurt twee uur en werd driemaal herhaald.
De momentopnames, om de vijf of tien minuten genomen, worden gesommeerd per half uur en het gemiddelde aantal springstaarten aanwezig per hokje in de arena wordt berekend. Van ieder half uur wordt dan het totale gemiddelde en de variantie berekend. Ook van de momentopnames wordt telkens het totale gemiddelde en de variantie berekend, zodat er ook een gedetailleerd beeld van de aggregatie voorhanden is.
De variantie wordt telkens gedeeld door het gemiddelde, dit om een graad van aggregatie te kunnen toekennen.
De drie verschillende soorten die ‘druppeltjes’ produceren, als zij geprikt worden, worden getest op hun reactie op de alarmvloeistof. Een aantal springstaarten, Ceratophysella gibbosa, Xenylla humicola of Brachystomella parvula, worden in een klein of grote arena geplaatst. Na een aantal uren klimatiseren, wordt er een glazen staafje in de arena geplaatst, met of zonder (blanco) een druppeltje ‘alarmferomoon’, afkomstig van een individu dat zich niet in de arena bevindt. Zowel de invloed van het ‘alarmferomoon’ van de eigen soort als van een andere soort wordt getest.
Glas wordt fijngetrokken en een collembol wordt met het glazen staafje op zijn achterlijf geprikt, er komt een druppeltje alarmvloeistof vrij dat opgevangen wordt op het glazen staafje. Van dit glazen staafje wordt met een steriele pincet het stukje met het druppeltje op afgebroken. Dit afgebroken staafje wordt dan direct in de arena geplaatst.
De positie van de collembolen wordt elke moment genoteerd op voorgedrukte papieren met arena’s gedurende minimum een 15 minuten.
De verwerking van de gegevens is een moeilijke kwestie. De gegevens bestaan voornamelijk uit observaties. Het gemiddelde aantal individuen per hokje in de arena wordt telkens berekend. Hiervoor worden de eerste twee momentopnames niet meegerekend, daar de eerste de positie van de Collembola is voordat het glasstaafje, met of zonder alarmvloeistof, in de arena werd gebracht. De tweede momentopname is het moment waarop het glasstaafje in de arena wordt gebracht. Vanaf de derde momentopname wordt het gemiddelde genomen, dit is het moment net nadat het glasstaafje in de arena is gebracht. Er wordt verwacht dat de collembolen direct reageren op het alarmferomoon.
In de blancos wordt het gemiddelde genomen van de plaats overeenkomstig met de plaats waar het glasstaafje met de alarmvloeistof werd gelegd. Als het glasstaafje met de alarmvloeistof, bijvoorbeeld, in de hoek gelegd wordt, wordt het gemiddelde berekend van het aantal springstaarten in de vier hoeken in de blancoproef.
Een vijftal spinnen (Pelecopsis memoralis) zijn voorhanden, ze werden voordien gevoed met Isotoma viridis. Na twee weken zonder eten wordt een hongerige spin in een plastieken potje (diameter = 5cm, hoogte = 2,5cm) met een gips-norietbodem geplaatst. Bij de spin worden een vijftal springstaarten gestopt van één bepaalde soort; Isotoma viridis, Xenylla humicola, Brachystomella parvula, Ceratophysella gibbosa of Folsomia candida. Een paar keer werden zowel vijf Isotoma’s, als vijf Brachystomella’s bij de spin gedropt. Onder een binoculaire loep (WILD M3) en met koude lichtbron (VOLPI AG, ultralux 500-H) observeert men wat er gebeurt. De vangtijden worden zover mogelijk genoteerd en ook de tijd nodig voor de vertering. Opvallende gedragingen worden als speciale opmerkingen genoteerd.
3.5. Chromatografische analyse
Als Brachystomella parvula in het abdomen wordt geprikt, komt er een kleverig druppeltje vrij. Dit wordt als een druppel alarmvloeistof beschouwd, cfr. een predator die de springstaart aanvalt en prikt.
Na glas fijngetrokken te hebben, wordt daarmee de collembol geprikt op het achterlijf. Met het glazen staafje wordt de druppel opgevangen en in 0,5 ml methanol (in een eppendorfje) gedompeld. Na dit met zoveel mogelijk Brachystomella gedaan te hebben, injecteert men een microliter van de oplossing in de gaschromatograaf.
Als blanco gebruikt men 0,5 ml alcohol in een eppendorfje, waarin een juist fijngetrokken glazen staafje in gedompeld wordt. Ook van deze oplossing injecteert men een microliter in de gaschromatograaf.
Er worden zoveel mogelijk (30-50 individuen van Folsomia en Isotoma, 300-350 Brachystomella) springstaarten van eenzelfde soort ingevrozen bij een temperatuur van -10°C. De springstaarten worden verzameld in een plastieken potje, waarna men het potje voor minimum 24h in de diepvriezer zet. Na een dag wordt er een minimale hoeveelheid
methanol aan toegevoegd. Van dit mengsel zal uiteindelijk een microliter in de gaschromatograaf belanden.
Dit experiment is uitgevoerd met drie soorten Brachystomella parvula, Folsomia candida en Isotoma viridis.
Bereiding van de vetzure methylesters:
Eerst en vooral gaat men de vetzuren verzepen. De behandeling met een sterke alcoholische base, in combinatie met hitte en druk, doodt en lyseert de cellen; de vetzuren komen vrij en worden omgezet tot natriumzouten (verzeping). Hierop volgt de methylatie; de vetzuren worden omgezet in methylesters. De methylesters vertonen een hogere vluchtigheid dan de
vetzuren zelf, wat noodzakelijk is voor gaschromatografische analyse. Na extractie van de methylesters uit de waterige fase, worden de vrije vetzuren en de resterende reagentia uit de organische fase gewassen. Ze zijn namelijk nefast voor de kolom. Van de organische fase wordt 2/3 overgepipetteerd in een gaschromatografie-flesje.
De scheiding van de vetzure methylesters wordt uitgevoerd met GLC (gas liquid chromatografie). Voor de gaschromatografische analyse wordt gebruik gemaakt van en Hewlett Packart model 589063. Alle gaschromatografische methoden berusten op de verschillen in de verdeling van de te scheiden componenten over twee fasen, namelijk de stationaire en de mobiele fase. Een detector maakt het resultaat van de gaschromatografische scheiding zichtbaar. Hier werd een vlamionisatiedetector (FID: flame ionisation detector) gebruikt.
Voor elk extract wordt uit de retentietijden van de verschillende pieken bepaald welke vetzuren aanwezig zijn. Uit de oppervlakte onder de pieken wordt de concentratie van elk vetzuur bepaald aan de hand van het "Microbial Identification System" software pakket (MIS) versie 3.90 (Microbial Identification System, Delaware, USA)
De vetzuur profielen bekomen voor de stammen werden met elkaar vergeleken en gegroepeerd door numerieke analyse. Voor het opstellen van een dendrogram werden Euclidische afstanden berekend tussen elk paar vetzuurprofielen, deze werden vervolgens geclusterd door middel van de "Unweighted Pair Group Method Using Averages" (UPGMUA) methode (Sneath en Sokal, 1973). Tevens werden de resultaten onderworpen aan een principale componenten analyse (PCA) (Sneath en Sokal, 1973) en uitgezet in twee-dimensionale puntendiagrammen.
3.6. Preparatie voor determinatie van de Collembola
Er wordt zowel een snelle methode als een langzame methode gebruikt. Indien geen bewaarpreparaten nodig zijn, gebruikt men best de ‘langzame’ werkwijze. Deze geeft de mooiste resultaten, waarna foto’s genomen kunnen worden. Er gaan wel enkele weken over voor men kan beginnen te determineren. Daarom worden enkele springstaarten opgeofferd voor een ‘snelle’ methode, zodat toch al gedetermineerd kan worden, maar met minder mooie resultaten.
Van elke soort worden een aantal springstaarten in alcohol gebracht. Van de alcohol worden ze overgebracht naar formol, waar ze een tijdje in blijven zitten. Daarna worden ze in een kaliumhydroxide-oplossing (10 %) overgezet voor het ophelderen van de diertjes. Hierbij moet men voorzichtig zijn en er op letten dat de springstaarten niet volledig oplossen, daarom
wordt af en toe nagekeken onder de binoculaire hoe de opheldering vordert. Antennae, ogen, klauwen, furca & mucro, genitaalplaat en dorsale chaetotaxie moeten goed zichtbaar zijn. Na een tweetal dagen als de Collembola voldoende opgehelderd zijn, worden ze gespoeld in gedestileerd water, waarna ze ingebed worden in glycerine (50% verdund). Dit alles wordt afgedekt met een dekglas, er wordt wel iets tussen gestoken, vb. een haar, zodat de springstaart niet plat geduwd wordt, en afgelakt met nagellak. Na enkele dagen drogen is het preparaat klaar voor de determinatie van de soorten.
De springstaarten worden vooreerst gefixeerd in Gisins fixeermiddel (2 à 3 dagen), daarna worden ze gestockeerd in ethanol. In ethanol zijn de diertjes onbeperkt bewaarbaar, de specimens krimpen wel ineen wegens de ontwatering van de ethanol. Om de collembolen te determineren worden ze gerelaxeerd in Gisins onderzoekmedium op basis van melkzuur, dit voor enkele dagen tot weken indien mogelijk of nodig. Het determineren zelf gebeurt met een stereomicroscoop, om de habitus te bekijken, en een fasecontrastmicroscoop, om details te bekijken.
De springstaarten worden gedetermineerd aan de hand van sleutels voor de determinatie van Collembola van Gisin (1960), Fjellberg (1980) en Hopkin (2000).
3.7.Scanning Elektronenmicroscopie
Ter voorbereiding voor de elektronenmicroscoop worden een aantal (+ 5 individuen) springstaarten per soort in een kleine, plastieken tube gestoken dat afgesloten wordt met netjes. Deze tubes wordt in een 70% oplossing alcohol gedaan, de netjes zorgen ervoor dat de alcohol in de tubes vloeit. De springstaarten in de tubes worden geleidelijk aan naar een 100% oplossing alcohol gebracht. Van 70% over 80%, naar 90, 96% en uiteindelijk 100% alcohol. De tubes blijven telkens een tiental minuten in de oplossing. Nadien worden de Collembola kritisch punt gedroogd en gecoat met een dun goudlaagje, waarna de diertjes klaar zijn om onder de elektronenmicroscoop bekeken te worden.
Van Brachystomella parvula, Xenylla humicola en Folsomia candida werd telkens een foto gemaakt van de habitus en een detailfoto van de cuticula aan de dorsale zijde.
3.8. Statistische verwerking
De individuen van een populatie kunnen verspreid zijn volgens drie basispatronen:
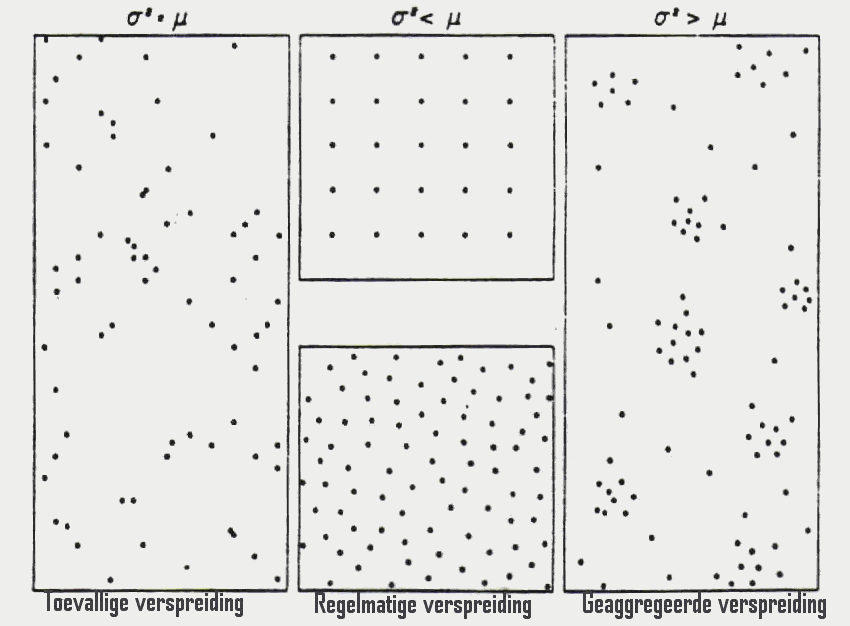
Figuur 17: Verspreiding van een populatie volgens drie basispatronen.
Het verband tussen de variantie (s ) en het rekenkundig gemiddelde (m ) bepaalt de verspreiding (dispersie) van een populatie:
Door deze verhoudingen na te gaan, kan men vaststellen of een populatie al dan niet geaggregeerd is.
Go to the
first,
previous,
next,
last
chapter,
overview.